

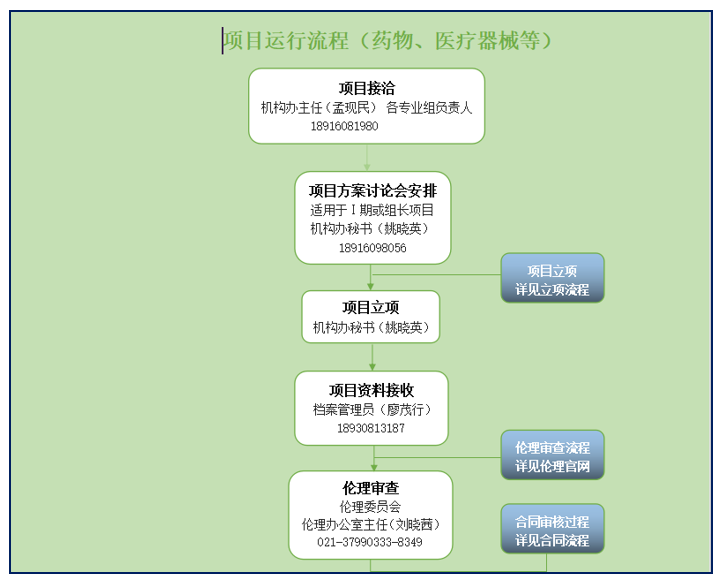
关于我中心临床试验项目运行的流程及流程环节的联系人和联系方式
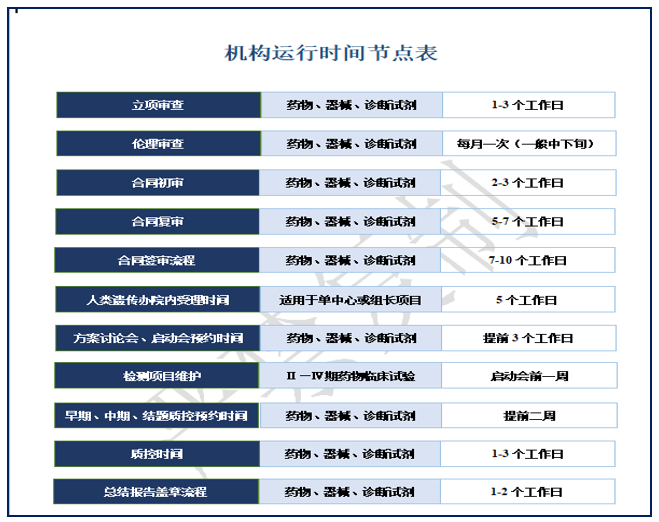
该流程包含项目运行流程中各个环节所需要的时间节点,除特殊情况外!
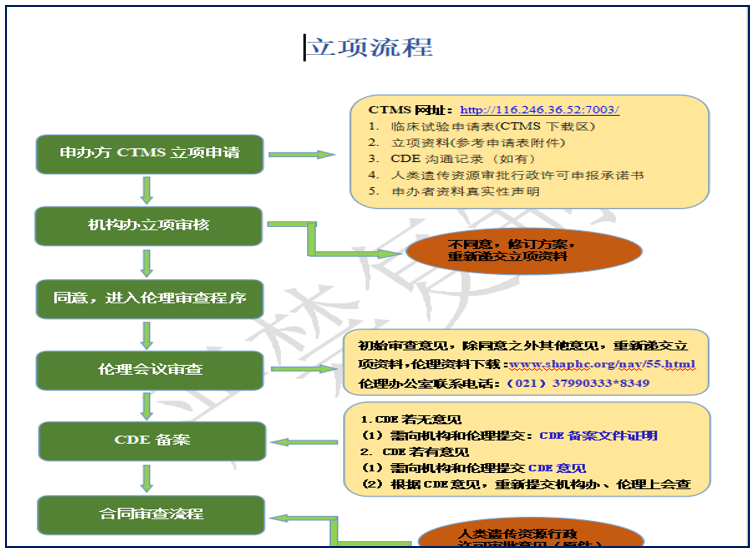
该流程涉及的内容是临床试验项目立项至合同审核之间应该走的流程,如有需要可在下载专区下载

适用于医疗、器械、试剂各期临床试验。体现了从项目合同提交审核至合同盖章之间全部流程。
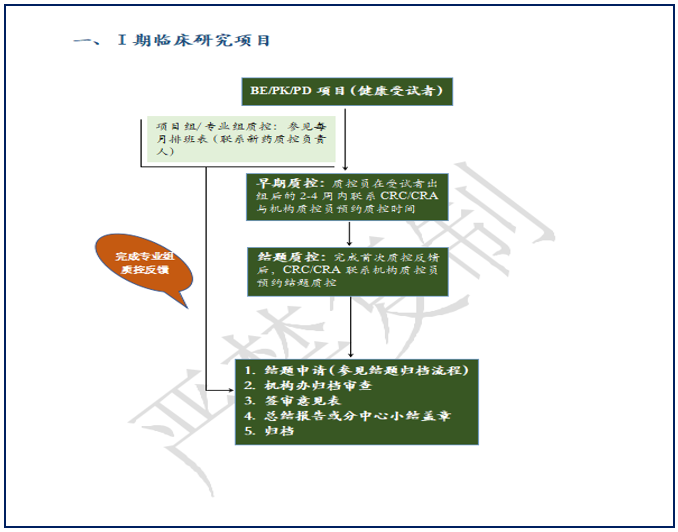
质控流程图分为I期临床研究项目和Ⅱ-Ⅳ期临床研究项目
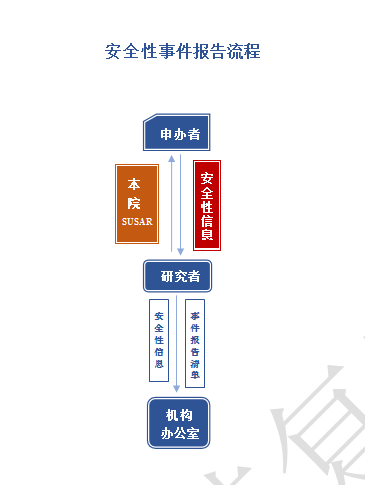
如发生非预期性事件(susar)都必须及时报告给申办方;研究者将收到申办方的安全性信息文件和安全性信息清单一起递交本中心机构备案。

本制度适用于我中心的合作方(制药公司、医院、合同研究组织、第三方实验室也可称为项目合作方)中有外资背景或涉及采集、保藏、利用、对外提供我国人类遗传资源的临床试验项目。